Регуляторные сигналы в организме не ограничиваются химическими и электрическими. Есть еще один вид важных сигналов для клеток — механические (из внешней среды и возникающие в самом организме), которым незаслуженно придается меньшее значение. В обзоре обобщается новая информация о механосенситивности различных клеток соединительной ткани и нервной системы. Приводятся примеры участия механических стимулов в регуляции роста, развития, дифференцировки и функционирования тканей и органов. Основное внимание уделяется таким процессам, как ремоделирование костной ткани, заживление ран, рост нейритов, формирование нейронных сетей. Описаны механизмы механотрансдукции, участвующие в них клеточные органеллы и молекулы с механосенситивными свойствами, показана роль внеклеточного матрикса. Исследуется значение механосенситивности и механических свойств клеток в развитии некоторых патологий. Рассматривается возможная роль механосенситивности в реализации эффектов механических и мануальных методов лечения.
Введение
Говоря о регуляции различных процессов в организме, обычно подразумевают нервно-гуморальную регуляцию, сигналами которой для клеток служат потенциалы действия и молекулы физиологически активных веществ. Однако в организме есть еще один вид важных сигналов для клеток — механические (из внешней среды и возникающие в самом организме). Различные виды движений (сокращения скелетных мышц, сердца и гладкомышечных органов, поддержание определенной позы и т.п.) создают давление и натяжение в разных анатомических структурах. Механические силы в организме можно разделить на напряжение растяжения, сжатия, вибрацию, гидростатическое давление и напряжение сдвига, обусловленное потоком жидкости.
Соединительнотканные оболочки (фасции) образуют единую тенсегрированную систему (от англ. tensegrity — напряженная целостность), объединяющую структуры человеческого тела. Начинаясь от соединительнотканных перегородок подкожно-жировой клетчатки, фасции переходят на мышечные группы, мышцы и отдельные мышечные волокна; они образуют оболочки, покрывающие внутренние органы, оплетают нервы, покрывают спинной и головной мозг. Все эти структуры соединяются между собой, образуя фиброзный скелет организма. Таким образом, с помощью фасций все внутренние органы связаны между собой и со скелетными мышцами. Вследствие единства соединительнотканного каркаса механические сигналы передаются по фасциям всего организма на органы и ткани. Живые организмы используют принцип тенсегрити, чтобы механически стабилизировать свою форму, а также интегрировать и сбалансировать свою структуру и функции от молекулярного уровня до организменного.
Знание о том, что механические силы регулируют развитие и ремоделирование тканей, появилось более века назад, когда Джулиус Вольф (Wolff J. Das Gesetz der Transformation der Knochen, 1892) заметил, что костные трабекулы координируются с основными линиями напряжений, вызванных ежедневной физической нагрузкой, и предположил, что костная ткань способна адаптировать свою архитектуру к механической среде. В последней четверти прошлого века появились исследования, показавшие, что механические сигналы являются специфичными для соединительной ткани.
Механочувствительность — это способность клеток воспринимать физические сигналы и механические силы из своего микроокружения. Исследования механических свойств и механочувствительности различных клеток значительно отстают от электрофизиологических, молекулярных и генетических исследований. Прогресс в изучении часто зависит от наличия соответствующей методологии. Только в последнее время были разработаны методы, которые могут быть использованы для количественного зондирования и контроля механических параметров, таких как жесткость тканей, клеток и субклеточных структур, внутриклеточные силы натяжения. Большинство этих методов основаны на контакте, являются инвазивными и/или пригодными только для исследований in vitro. Крайне затруднительно изучать влияние механических факторов на различные процессы in vivo.
Исследования последних лет показали, что механические силы влияют на рост и форму практически всех тканей в организме человека. Деформации с уровня ткани передаются через внеклеточный матрикс (ВКМ) к клеткам. В случае плюрипотентных клеток эти процессы направляют последующую дифференцировку соответствующим образом.
Характер взаимодействия клетки с ВКМ определяет степень испытываемой деформации, которая может быть ослаблена или усилена, точно так же характер ядерных взаимодействий с цитоскелетом определяет степень ядерной деформации в ответ на давление или натяжение.
В задачу авторов входило систематизировать данные о механосенситивности клеток различных органов и тканей, о механизмах механотрансдукции и о роли механических стимулов в регуляции функций и реализации эффектов физических методов лечения.
Влияние механических сигналов на соединительную ткань
Известно, что деформация клеток соединительной ткани, возникающая под действием механического напряжения в ней, вызывает индукцию синтеза структурных биополимеров и, как следствие, изменение строения межклеточного матрикса. Такая перестройка необходима для сохранения соответствия между вязкоупругими свойствами ткани и изменениями напряжения в ней. При растяжении соединительной ткани активируется синтез коллагена и эластина, но прирост коллагена примерно в три раза больше, что было установлено на примере стенки аорты. Деформация клеток под действием механического напряжения вызывает индукцию синтеза коллагена. Под действием механической нагрузки степень поперечного связывания коллагена снижается, а степень его растворимости увеличивается.
В.В. Серов и А.Б. Шехтер с соавт. сформулировали концепцию биомеханического контроля морфогенеза, согласно которой фибробласт определяет микроархитектонику своего окружения, а популяция клеток — архитектонику всей ткани. Контрольным механизмом в этом процессе является соответствие структуры и биомеханической функции. Волокна, которые не соответствуют линиям механического напряжения, т.е. не несут функциональной нагрузки, резорбируются, а другие увеличиваются в объеме до тех пор, пока не достигнут «биомеханического соответствия». Путем обратных связей между клетками и ВКМ осуществляется конструирование тканей.
Известно, что кости непрерывно разрушаются и восстанавливаются в процессе ремоделирования, остеобласты формируют новую кость, а остеокласты резорбируют установленную кость. Хотя многие факторы, такие как диета, уровень гормонов и возраст, могут склонить этот баланс в сторону костеобразования или резорбции, механические стимулы являются важнейшим фактором в укреплении костной структуры, а динамическая механическая среда признается необходимой для формирования и поддержания здоровой кости. Постнатальное формирование костей контролируется остеогенными клетками, которые реагируют на различные механические стимулы. Отсутствие таких стимулов (паралич) или воздействие внешней механической разгрузки (во время постельного режима или в невесомости) уменьшают образование несущей кости и ослабляют костную структуру.
Исходы ремоделирования кости в ответ на механическую нагрузку зависят от рекрутирования мезенхимальных стволовых клеток (МСК) костного мозга в остеогенную линию. Когда физическая нагрузка отсутствует, МСК имеют тенденцию входить в адипогенную линию — фенотип, который преобладает у параплегических, малоподвижных и пожилых людей. В костном мозге МСК располагаются в непосредственной близости от костных поверхностей и непрерывно подвергаются механической информации, индуцируемой физической нагрузкой. Когда механосенсорная способность этих клеток-предшественников нарушается (при старении), механические сигналы не могут вызвать соответствующие решения о судьбе клеток, что в конечном итоге способствует развитию остеопороза.
Мезенхимальные стволовые клетки — это взрослые мультипотентные клетки с большим потенциалом к самообновлению и дифференцировке в многочисленные клеточные линии. Эти клетки получают из различных мезенхимальных тканей, таких как костный мозг, жировая ткань, пуповина и дерма. Для направления их дифференцировки и пролиферации важны свойства ВКМ (архитектоника, жесткость и пр.) и внешние механические стимулы. В зависимости от интенсивности деформации МСК проявляют специфическую дифференцировку. Например, при деформации костномозговых МСК на 3 и 10% наблюдается соответственно остеогенез либо формирование сухожилия. Колебательный поток жидкости индуцирует напряжение сдвига и, как оказалось, способствует как остеогенной, так и миогенной дифференцировке. Компрессионная нагрузка в свою очередь способствует хондрогенной дифференцировке МСК, повышает экспрессию генов хондрогенных маркеров, таких как коллаген II и аггрекан. Другое исследование показало, что этот тип внешних механических сигналов может индуцировать остеогенную дифференцировку МСК, увеличивая образование костного матрикса и отложение кальция. Вибрация способствует остеогенезу, увеличивая экспрессию остеогенных маркеров (остеопонтин и остеокальцин).
Заживление ран представляет собой сложный многоступенчатый процесс, который включает ряд различных типов клеток и требует жесткой регуляции биохимических и биомеханических сигналов. Фибробласты ремоделируют ВКМ внутри раны, для того чтобы механически обеспечить стабильность и «подложку» для других клеток и факторов роста. На ранних стадиях заживления ран дермальные фибробласты инфильтрируют очаг поражения и секретируют белки ВКМ, такие как коллаген и эластин. Между ВКМ и фибробластами существует двусторонняя механическая связь посредством интегринов, связанных с внутриклеточными механочувствительными адаптерами и сигнальными белками (см. ниже), благодаря которым происходит перестройка и ремоделирование ВКМ в соответствии с механическим напряжением. Эти двунаправленные динамические механические связи между клеткой и ее окружением имеют решающее значение для структуры и функции ткани, а их нарушения, скорее всего, способствуют формированию келоидов. Известно, что участки кожи, подвергающиеся сильному растяжению и сжатию, проявляют повышенную восприимчивость к развитию келоидных рубцов.
Таким образом, клетки соединительной ткани чувствительны к различным механическим стимулам, которые участвуют в регуляции их дифференцировки, размножения и функционирования. Отсюда следует практический вывод: дозируемое и направляемое напряжение или, наоборот, снятие такового, может явиться средством воздействия на архитектонику соединительной ткани и сигналом к ее перестройке.
Влияние механических стимулов на развитие нервной системы
До сих пор развитие нервной системы рассматривали в значительной степени в контексте биохимии, молекулярной биологии и генетики. Считается, что большинство клеток нервной системы реагируют только на химические сигналы. Однако появляется все больше свидетельств того, что нервная система также интегрирует механическую информацию для регуляции дифференцировки нейронных клеток-предшественников, миграции нейронов, роста аксонов и дендритов, образования извилин коры. Исследования in vitro показывают, что многие типы нейронов, а также глиальных клеток реагируют на механические сигналы на протяжении всего своего развития.
Нейроны имеют длинные отростки, которые находятся под механическим напряжением. В более широком масштабе нервная ткань развивающихся организмов также находится под напряжением. Взрослая нервная ткань механически неоднородна: установлена разница между механическими свойствами белого и серого вещества мозга. Кроме того, жесткость взрослой мозговой ткани увеличивается с возрастом. Таким образом, в процессе развития механические свойства нервной ткани подвержены изменениям и клетки сталкиваются с различными механическими сигналами в зависимости от местоположения и стадии развития. Можно предположить, что на определенной стадии развития жесткость кортикальной ткани может превысить критический порог, способствуя тем самым переходу от нейрогенеза к глиогенезу. Повышенная экспрессия глиальных фибриллярных кислотных белков в астроцитах приводит к увеличению жесткости нервной ткани, что вызывает или, по крайней мере, способствует снижению нейрогенеза. Напротив, дифференцировка шванновских клеток и клеток-предшественников олигодендроцитов, которые являются глиальными клетками, увеличивается с увеличением жесткости.
Складчатость коры головного мозга млекопитающих приводит к распределению механических напряжений в извилинах. Нейробласты начинают дифференцироваться раньше в верхней части извилин, чем в их основании, они раньше увеличиваются в размерах, и степень развития их дендритов значительно более выражена, что указывает на то, что механическое напряжение может быть вовлечено в развитие клеток-предшественников. Подтверждают эту гипотезу исследования, демонстрирующие, что механическое напряжение in vitro приводит к дифференцировке нервных стволовых клеток в сторону зрелых нейрональных клеток.
Многие типы нейрональных клеток адаптируют свою морфологию, в частности число, длину и структуру ветвления своих нейритов, к жесткости своего субстрата in vitro, включая ганглиозные клетки спинного мозга млекопитающих, нейроны спинного мозга и гиппокампа, но не всегда нейроны коры головного мозга. Рост нейритов — это механический процесс, и как таковой он вполне может быть обусловлен взаимодействием между нейритами и механической средой in vivo. От начала роста нейритов до установления синаптических связей с клеткой-мишенью и формирования устойчивых нейронных сетей они постоянно находятся под механическим напряжением. Напряжение выше или ниже определенного порога стимулирует рост или ретракцию нейритов соответственно (рис. 1).
Введение
Говоря о регуляции различных процессов в организме, обычно подразумевают нервно-гуморальную регуляцию, сигналами которой для клеток служат потенциалы действия и молекулы физиологически активных веществ. Однако в организме есть еще один вид важных сигналов для клеток — механические (из внешней среды и возникающие в самом организме). Различные виды движений (сокращения скелетных мышц, сердца и гладкомышечных органов, поддержание определенной позы и т.п.) создают давление и натяжение в разных анатомических структурах. Механические силы в организме можно разделить на напряжение растяжения, сжатия, вибрацию, гидростатическое давление и напряжение сдвига, обусловленное потоком жидкости.
Соединительнотканные оболочки (фасции) образуют единую тенсегрированную систему (от англ. tensegrity — напряженная целостность), объединяющую структуры человеческого тела. Начинаясь от соединительнотканных перегородок подкожно-жировой клетчатки, фасции переходят на мышечные группы, мышцы и отдельные мышечные волокна; они образуют оболочки, покрывающие внутренние органы, оплетают нервы, покрывают спинной и головной мозг. Все эти структуры соединяются между собой, образуя фиброзный скелет организма. Таким образом, с помощью фасций все внутренние органы связаны между собой и со скелетными мышцами. Вследствие единства соединительнотканного каркаса механические сигналы передаются по фасциям всего организма на органы и ткани. Живые организмы используют принцип тенсегрити, чтобы механически стабилизировать свою форму, а также интегрировать и сбалансировать свою структуру и функции от молекулярного уровня до организменного.
Знание о том, что механические силы регулируют развитие и ремоделирование тканей, появилось более века назад, когда Джулиус Вольф (Wolff J. Das Gesetz der Transformation der Knochen, 1892) заметил, что костные трабекулы координируются с основными линиями напряжений, вызванных ежедневной физической нагрузкой, и предположил, что костная ткань способна адаптировать свою архитектуру к механической среде. В последней четверти прошлого века появились исследования, показавшие, что механические сигналы являются специфичными для соединительной ткани.
Механочувствительность — это способность клеток воспринимать физические сигналы и механические силы из своего микроокружения. Исследования механических свойств и механочувствительности различных клеток значительно отстают от электрофизиологических, молекулярных и генетических исследований. Прогресс в изучении часто зависит от наличия соответствующей методологии. Только в последнее время были разработаны методы, которые могут быть использованы для количественного зондирования и контроля механических параметров, таких как жесткость тканей, клеток и субклеточных структур, внутриклеточные силы натяжения. Большинство этих методов основаны на контакте, являются инвазивными и/или пригодными только для исследований in vitro. Крайне затруднительно изучать влияние механических факторов на различные процессы in vivo.
Исследования последних лет показали, что механические силы влияют на рост и форму практически всех тканей в организме человека. Деформации с уровня ткани передаются через внеклеточный матрикс (ВКМ) к клеткам. В случае плюрипотентных клеток эти процессы направляют последующую дифференцировку соответствующим образом.
Характер взаимодействия клетки с ВКМ определяет степень испытываемой деформации, которая может быть ослаблена или усилена, точно так же характер ядерных взаимодействий с цитоскелетом определяет степень ядерной деформации в ответ на давление или натяжение.
В задачу авторов входило систематизировать данные о механосенситивности клеток различных органов и тканей, о механизмах механотрансдукции и о роли механических стимулов в регуляции функций и реализации эффектов физических методов лечения.
Влияние механических сигналов на соединительную ткань
Известно, что деформация клеток соединительной ткани, возникающая под действием механического напряжения в ней, вызывает индукцию синтеза структурных биополимеров и, как следствие, изменение строения межклеточного матрикса. Такая перестройка необходима для сохранения соответствия между вязкоупругими свойствами ткани и изменениями напряжения в ней. При растяжении соединительной ткани активируется синтез коллагена и эластина, но прирост коллагена примерно в три раза больше, что было установлено на примере стенки аорты. Деформация клеток под действием механического напряжения вызывает индукцию синтеза коллагена. Под действием механической нагрузки степень поперечного связывания коллагена снижается, а степень его растворимости увеличивается.
В.В. Серов и А.Б. Шехтер с соавт. сформулировали концепцию биомеханического контроля морфогенеза, согласно которой фибробласт определяет микроархитектонику своего окружения, а популяция клеток — архитектонику всей ткани. Контрольным механизмом в этом процессе является соответствие структуры и биомеханической функции. Волокна, которые не соответствуют линиям механического напряжения, т.е. не несут функциональной нагрузки, резорбируются, а другие увеличиваются в объеме до тех пор, пока не достигнут «биомеханического соответствия». Путем обратных связей между клетками и ВКМ осуществляется конструирование тканей.
Известно, что кости непрерывно разрушаются и восстанавливаются в процессе ремоделирования, остеобласты формируют новую кость, а остеокласты резорбируют установленную кость. Хотя многие факторы, такие как диета, уровень гормонов и возраст, могут склонить этот баланс в сторону костеобразования или резорбции, механические стимулы являются важнейшим фактором в укреплении костной структуры, а динамическая механическая среда признается необходимой для формирования и поддержания здоровой кости. Постнатальное формирование костей контролируется остеогенными клетками, которые реагируют на различные механические стимулы. Отсутствие таких стимулов (паралич) или воздействие внешней механической разгрузки (во время постельного режима или в невесомости) уменьшают образование несущей кости и ослабляют костную структуру.
Исходы ремоделирования кости в ответ на механическую нагрузку зависят от рекрутирования мезенхимальных стволовых клеток (МСК) костного мозга в остеогенную линию. Когда физическая нагрузка отсутствует, МСК имеют тенденцию входить в адипогенную линию — фенотип, который преобладает у параплегических, малоподвижных и пожилых людей. В костном мозге МСК располагаются в непосредственной близости от костных поверхностей и непрерывно подвергаются механической информации, индуцируемой физической нагрузкой. Когда механосенсорная способность этих клеток-предшественников нарушается (при старении), механические сигналы не могут вызвать соответствующие решения о судьбе клеток, что в конечном итоге способствует развитию остеопороза.
Мезенхимальные стволовые клетки — это взрослые мультипотентные клетки с большим потенциалом к самообновлению и дифференцировке в многочисленные клеточные линии. Эти клетки получают из различных мезенхимальных тканей, таких как костный мозг, жировая ткань, пуповина и дерма. Для направления их дифференцировки и пролиферации важны свойства ВКМ (архитектоника, жесткость и пр.) и внешние механические стимулы. В зависимости от интенсивности деформации МСК проявляют специфическую дифференцировку. Например, при деформации костномозговых МСК на 3 и 10% наблюдается соответственно остеогенез либо формирование сухожилия. Колебательный поток жидкости индуцирует напряжение сдвига и, как оказалось, способствует как остеогенной, так и миогенной дифференцировке. Компрессионная нагрузка в свою очередь способствует хондрогенной дифференцировке МСК, повышает экспрессию генов хондрогенных маркеров, таких как коллаген II и аггрекан. Другое исследование показало, что этот тип внешних механических сигналов может индуцировать остеогенную дифференцировку МСК, увеличивая образование костного матрикса и отложение кальция. Вибрация способствует остеогенезу, увеличивая экспрессию остеогенных маркеров (остеопонтин и остеокальцин).
Заживление ран представляет собой сложный многоступенчатый процесс, который включает ряд различных типов клеток и требует жесткой регуляции биохимических и биомеханических сигналов. Фибробласты ремоделируют ВКМ внутри раны, для того чтобы механически обеспечить стабильность и «подложку» для других клеток и факторов роста. На ранних стадиях заживления ран дермальные фибробласты инфильтрируют очаг поражения и секретируют белки ВКМ, такие как коллаген и эластин. Между ВКМ и фибробластами существует двусторонняя механическая связь посредством интегринов, связанных с внутриклеточными механочувствительными адаптерами и сигнальными белками (см. ниже), благодаря которым происходит перестройка и ремоделирование ВКМ в соответствии с механическим напряжением. Эти двунаправленные динамические механические связи между клеткой и ее окружением имеют решающее значение для структуры и функции ткани, а их нарушения, скорее всего, способствуют формированию келоидов. Известно, что участки кожи, подвергающиеся сильному растяжению и сжатию, проявляют повышенную восприимчивость к развитию келоидных рубцов.
Таким образом, клетки соединительной ткани чувствительны к различным механическим стимулам, которые участвуют в регуляции их дифференцировки, размножения и функционирования. Отсюда следует практический вывод: дозируемое и направляемое напряжение или, наоборот, снятие такового, может явиться средством воздействия на архитектонику соединительной ткани и сигналом к ее перестройке.
Влияние механических стимулов на развитие нервной системы
До сих пор развитие нервной системы рассматривали в значительной степени в контексте биохимии, молекулярной биологии и генетики. Считается, что большинство клеток нервной системы реагируют только на химические сигналы. Однако появляется все больше свидетельств того, что нервная система также интегрирует механическую информацию для регуляции дифференцировки нейронных клеток-предшественников, миграции нейронов, роста аксонов и дендритов, образования извилин коры. Исследования in vitro показывают, что многие типы нейронов, а также глиальных клеток реагируют на механические сигналы на протяжении всего своего развития.
Нейроны имеют длинные отростки, которые находятся под механическим напряжением. В более широком масштабе нервная ткань развивающихся организмов также находится под напряжением. Взрослая нервная ткань механически неоднородна: установлена разница между механическими свойствами белого и серого вещества мозга. Кроме того, жесткость взрослой мозговой ткани увеличивается с возрастом. Таким образом, в процессе развития механические свойства нервной ткани подвержены изменениям и клетки сталкиваются с различными механическими сигналами в зависимости от местоположения и стадии развития. Можно предположить, что на определенной стадии развития жесткость кортикальной ткани может превысить критический порог, способствуя тем самым переходу от нейрогенеза к глиогенезу. Повышенная экспрессия глиальных фибриллярных кислотных белков в астроцитах приводит к увеличению жесткости нервной ткани, что вызывает или, по крайней мере, способствует снижению нейрогенеза. Напротив, дифференцировка шванновских клеток и клеток-предшественников олигодендроцитов, которые являются глиальными клетками, увеличивается с увеличением жесткости.
Складчатость коры головного мозга млекопитающих приводит к распределению механических напряжений в извилинах. Нейробласты начинают дифференцироваться раньше в верхней части извилин, чем в их основании, они раньше увеличиваются в размерах, и степень развития их дендритов значительно более выражена, что указывает на то, что механическое напряжение может быть вовлечено в развитие клеток-предшественников. Подтверждают эту гипотезу исследования, демонстрирующие, что механическое напряжение in vitro приводит к дифференцировке нервных стволовых клеток в сторону зрелых нейрональных клеток.
Многие типы нейрональных клеток адаптируют свою морфологию, в частности число, длину и структуру ветвления своих нейритов, к жесткости своего субстрата in vitro, включая ганглиозные клетки спинного мозга млекопитающих, нейроны спинного мозга и гиппокампа, но не всегда нейроны коры головного мозга. Рост нейритов — это механический процесс, и как таковой он вполне может быть обусловлен взаимодействием между нейритами и механической средой in vivo. От начала роста нейритов до установления синаптических связей с клеткой-мишенью и формирования устойчивых нейронных сетей они постоянно находятся под механическим напряжением. Напряжение выше или ниже определенного порога стимулирует рост или ретракцию нейритов соответственно (рис. 1).
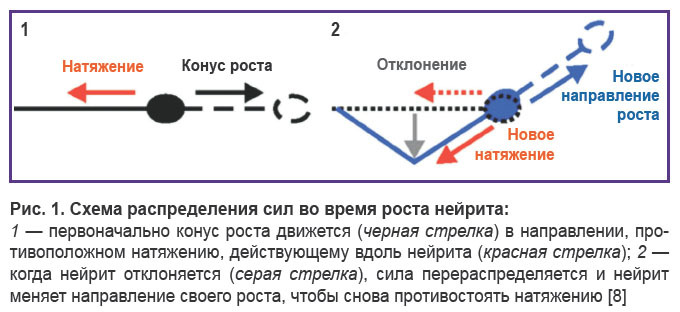
B.J. Pfister и соавт. показали, что механическое натяжение индуцирует экстремальный рост растяжения интегрированных аксонных трактов с поразительной скоростью и протяженностью (8 мм/сут). Это показывает, что аксональное удлинение в основном ограничено относительным отсутствием натяжения. Соответственно, когда нейроны культивируются на гибком субстрате, длина нейритов значительно увеличивается с увеличением растяжения субстрата, и нейриты предпочтительно выравниваются вдоль направления растяжения.
Аналогичным образом напряжение может влиять на окончательную морфологию нейронных сетей. Как только нейрит соединяется со своей целью, напряжение способствует его стабилизации; в то же время он вызывает ретракцию или элиминацию коллатеральных нейритов. Таким образом, напряжение может служить сигналом для аксонального и дендритного выживания, а снижение напряжения может, следовательно, способствовать остановке роста. Как только нейронная сеть соединится, нарастание механического напряжения приведет к укорочению вовлеченных нейритов, тем самым способствуя компактности нейронных схем.
Есть предположение, что напряжение способствует формированию синапса. Данные экспериментов in vivo показывают, что напряжение вдоль аксонов может активно регулироваться нейронами и даже участвовать в функционировании синапсов. Напряжение аксонов дрозофилы, например, способствует скоплению нейромедиаторных везикул в пресинаптических терминалях в нервно-мышечном соединении, и оно модулирует локальную и глобальную динамику везикул. Следовательно, механическое напряжение в аксонах нейронов и вдоль них может способствовать не только формированию нейронной сети, но и, в конечном счете, регуляции функционирования нейронов.
Гипотеза дифференциального расширения коры больших полушарий предполагает центральную роль механических сил, возникающих в процессе развития коры. В этой гипотезе также предполагается, что тангенциальное расширение кортикальных областей, которое обусловлено локальной усиленной пролиферацией клеток, а также изменениями их размеров и форм, является движущей силой для формирования борозд и извилин. Согласно другой модели, кортикальная складчатость обусловлена не серым веществом, а напряжением в белом веществе, которое создается кортико-кортикальными и кортико-подкорковыми связями. Оба механизма не являются взаимоисключающими и, вероятно, вносят совместный вклад в формирование мозга.
Таким образом, многие события в ходе развития нервной системы, по-видимому, контролируются механическими стимулами. Клеточная восприимчивость к механическим стимулам может использоваться как дополнительный уровень контроля процессов развития и как фундаментальный способ взаимодействия с изменяющейся средой. Следовательно, механические воздействия на нервную систему, особенно в процессе ее роста и развития, могут служить причиной различных нарушений, а также выступать в качестве лечебных факторов.
